そこで、まず第一に、1分子イメージング技術を開発させるために機能評価したい蛋白質側の調整方法についての開発が望まれ、GFP (オワンクラゲの緑色蛍光蛋白質)を蛍光色素のタグとして利用する系すなわち、GFP変異体との標的蛋白質の融合蛋白質である組み換え体の作製が必要とされた。すなわちイメージングに必要な蛍光を組み換え体の作製で解決しようとすることです。
次に蛋白質内の分子内構造変化や分子間相互作用(結合・解離)は様々な条件化で行われた三次元結晶構造解析やNMRをもちいて研究は行われている。しかし、それらの計測では生理的とはかけ離れた条件下で結晶化されたものの解析であったり、分子量の比較的大きなものは計測できなかったり、さらにゆっくりとしたゆらぎを測定する事は難しい。そこでFRET(蛍光エネルギー移動法)を用いて動的振る舞い並びにNMRでは計測することが難しい分子内のゆっくりとした動きを可視化し、解析することを目的としている。そのためには蛋白質の特異的な部位に蛍光色素を入れるためのタグの作製や蛍光蛋白質との融合蛋白質の作製が必要不可欠であると考えている。
最後に十分活性を持ったまま基板上や針の先に安定に固定するための組換え体の作製が1分子アッセイには望まれる。標的蛋白質の活性部位だけの欠失体や活性中心、結合ドメイン(相互作用部位)の変異体の作製は通常よく行われているが、それに加え活性中心や結合部位の機能を損なわない様に蛋白質1分子を固定するためのタグ付きの組み換え体の作製や天然のものとのハイブリッド蛋白質の作製は組み換え技術を用いた新たな工夫のある技である。
1分子機能アッセイを行うためには装置開発も非常に大事な研究であるが遺伝子グループの仕事も無くてはならないものであり、両者が共に力を出し合う事で、すばらしい研究が達成できると考えている。
| メンバー | 研究課題 |
| 岩根敦子 | 1分子レベルでの計測に耐えうる組み換え蛋白質の設計並びに作製 |
| 新井由之 | 低分子量Gタンパク質Rasの1分子可視化解析 |
| 本間和明 (UMASS) | Unconventional Myosinを究める!!! |
生理学的、生化学的に良く研究されてきた骨格筋のミオシンに注目し、ニワトリ胸筋の骨格筋ミオシン遺伝子(重鎖、軽鎖)のクローニング、1分子イメージングに必要な組み換え体蛋白質の設計・発現並びに1分子アッセイを行っている。
骨格筋のミオシンの動作メカニズム解明のためには装置の開発はもとより1分子レベルでの測定にふさわしい蛋白質の調製も必要不可欠である。第一に、十分活性を持ったまま基板上や針の先に安定に固定するための組み換え体の作製、第二としてはその蛋白質が1分子である事を証明するのに必要な、特異的に蛍光色素や蛍光蛋白質を導入するための組み換え体の作製を行ってきた。
ミオシンのモータードメインと呼ばれるS1はATPを加水分解するのと同様にアクチンフィラメントを動かしたり、張力を発することは解っている。しかし、S1によるアクチンフィラメントの運動速度はミオシン全長による運動と比べ数倍遅い。この事はS1だけでは正常な運動能をおこなうための重要な因子が欠落しているのか、あるいは人工的な基板の表面に結合するときに生じたS1分子の変性によるものであるかは判別出来なかった。そこでS1分子の活性を保持する組み換え体の作製を行った。ニワトリ平滑筋のミオシン調節軽鎖のcDNAをPCR法を用いてクローニングし、大腸菌内でビオチン化される組み換え蛋白質との融合蛋白質として発現・精製した。平滑筋のミオシン調節軽鎖は骨格筋の調節軽鎖より骨格筋ミオシン重鎖に対して親和性が高く、容易に交換できることを利用して、このビオチン化蛋白質をニワトリ骨格筋から抽出し、蛋白分解酵素パパインで切断して得たS1に内因性の調節軽鎖との交換反応により導入した。作製されたビオチン化S1はミオシン同程度の運動能を有した。すなわち、基板上にストレプトアビジンを介して変性させることなく固定できた(Iwane AH et.al, BBRC, 230:76-80,197)。また同様にビオチンーストレプトアビジンの系を介して針の先に安定に1分子レベルで固定した。作製されたビオチン化調節軽鎖には反応性の高いチオール基(システイン残基)を1つだけ持つので、その部位を蛍光色素(Cy3)でラベルした組換え体を用いてS1に導入することにより、1分子レベルのイメージング確認が行える。針の先に固定してミオシンS11分子のATP加水分解と力学的課程との関係を調べる研究(1分子捕捉・操作によるルースカップリングの直接証拠を示す)に応用された(Kitamura K et,al, Nature, 397: 129-134,1999)。
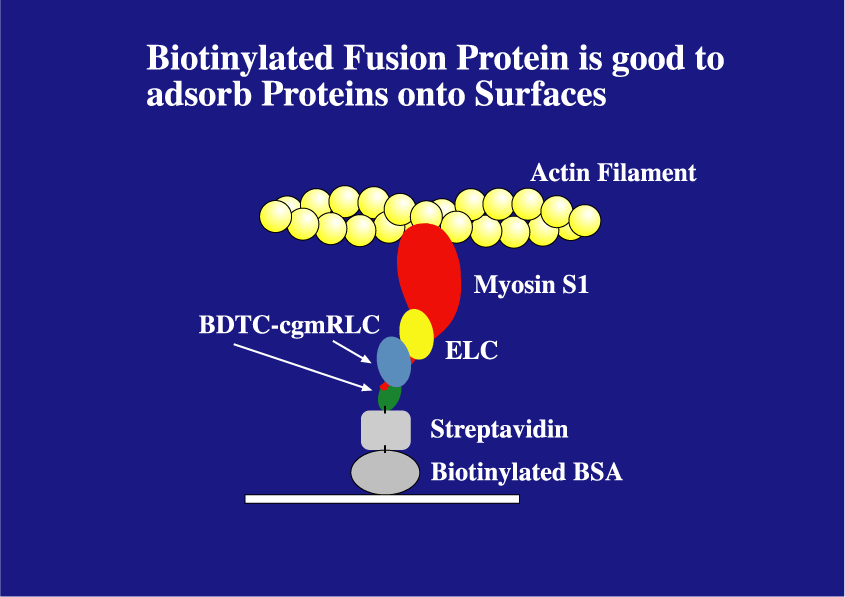
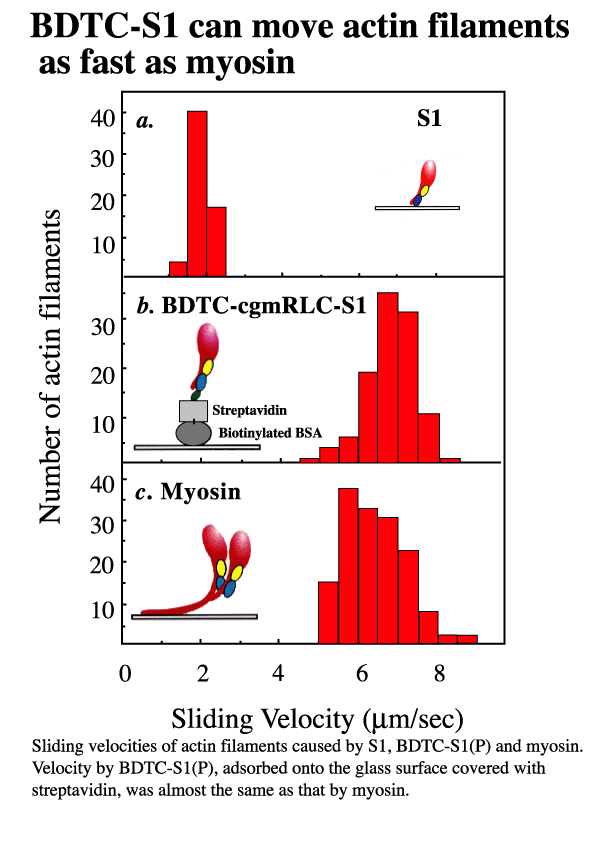
最後に、標的蛋白質を緑色生物蛍光蛋白質GFPの変異体との融合蛋白質として発現することにより、1分子イメージングに不可欠な蛍光色素よる導入に伴う蛋白質の変性を回避できると考えた。大腸菌やバキュウロウイルスどの通常の組み換え体の発現系を用いると活性のない不溶性の蛋白質として発現される蛋白質もウサギの網状赤血球ライゼートをもちいて試験管内発現させると簡単に短時間で活性体として蛋白質を得ることが期待される。GFPは低背景光全反射顕微鏡を用いると1分子レベルでイメージング出来きた。さらに、蛍光色素でラベルされたATP(Cy3ATP)を用いて骨格筋ミオシンS1組み換え体のATPase活性を測定し、蛋白質の1分子レベルでの機能評価を行った(Iwane AH et,al, FEBS Lett. 407 : 235-238 ,1997)。GFPによる標識法、組み換え蛋白質の試験管内発現、低背景光全反射顕微鏡、この3つの技術を組み合わせることにより、1分子レベルでの蛋白質の機能評価することが可能と考えられる。このアプローチにより従来の発現系を用いて活性型が得られなかった様々な蛋白質にミクロレベルの有効的な活性評価並びに細胞内などへの標的蛋白質のイメージングへの幅広い応用をもたらすものと期待される。
以上の様にミオシンの運動メカニズム等の機能評価を1分子レベルで行うためにひと工夫したミオシン蛋白質設計・作製を行っている。
少なくとも18種類の異なるfamilyのmyosinの存在がこれまでに分かっているが、生化学的、生物物理学的にcharacterizeされているmyosinは少ない。これらのmyosinのactin上の滑り速度、滑り方向、processivity、kinetics、制御機構などには相違点も多いが、また同時に類似点もある。自然界に既に存在するこれらのmyosinたちを一通り調べてお互いに比較することによって、myosinの分子メカニズムの本質が自ずと浮き彫りになってくるのではないだろうか?
このような信念をもとに、私達は日々、これらmyosinたちのcharacterizationに精を出しています。具体的にはこれらmyosinまたはその変異体を昆虫細胞で発現させて単離精製し、actin上の運動の方向性、運動速度、kinetics、Ca/CaMやkinaseを通しての制御様式を明らかにしています。更に生きたmammalian cellに導入することにより、それぞれのmyosinたちの細胞内での振る舞いを捕らえる試みもしています。
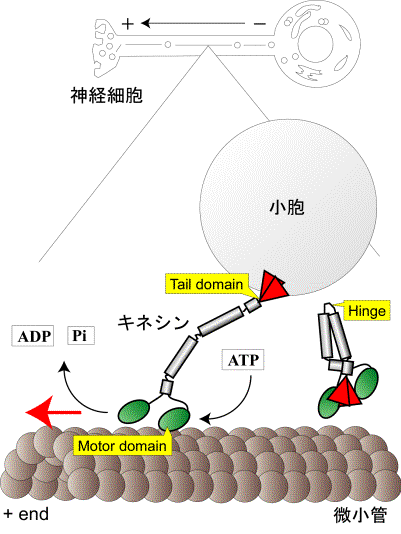
細胞が生きていくためには必要な栄養分を取り込んだり、不要な代謝物を排出したり、細胞内のイオン濃度の調節が行われており、これは細胞内物質輸送と呼ばれる。代表的な物質輸送の1つは小胞による輸送で、それは小胞の拡散による輸送以外にキネシン、ミオシン、ダイニンなどのモーター蛋白質が重要な役割を担っている事が解ってきた。特に神経細胞の長さにおいては2〜3mmのものから1mにも達するものもあり、その情報伝達のための小胞輸送を拡散のみで説明しようとすると時間的に無理がある。そこで輸送にキネシン類蛋白質の関与が不可欠であると考え、キネシンの動作原理の解明は重要な実験課題である。ミオシンと比べ、キネシンは1985年に同定されたばかりの比較的新しい蛋白質であり、生理学的、生化学的研究はあまり詳わしくされていなかったものの、大腸菌での組み換え体蛋白質の発現系が確立されているので近年、飛躍的に研究は進んでいる。モータードメインの大きさはモーター分子の中でもっとも小さく、ミオシン同様にATPの加水分解エネルギーを利用して動く。キネシンについての研究は分子モーターに共通な動作原理を解明するに手がかりが得られると考えて当グループでも組み換え体作製の系を立ち上げた。
まず、キネシンの結晶構造解析の結果からアミノ酸配列の相同性が低いにも関わらず、キネシンのモータードメインの構造がミオシンのATP加水分解部位と非常に似ている事が解った。それゆえ、キネシンのモータードメインに続くネックもレバーとして働く事により、運動に寄与しているかどうかを調べる目的でネックの長さとネックの堅さの異なるキネシンの組み換え体の設計・作製を行った。ショウジョウバエのキネシンはN末にGST(Glutathion S-transferase)をC末にはマレイミド化した蛍光色素やビオチンとの反応性の高いチオール基を有するCysを挿入した融合蛋白質として大腸菌で発現し、後に、途中でソロンビンにより、GSTを除いたキネシン組み換え蛋白質として得た。C末の反応性の高いチオール基は光ピンセット法を用いたナノ計測システムに必要なビーズへのこれらキネシン組み換え体の活性を保持させて1分子レベルで安定に結合させるもの、また、1分子レベル運動能を観察する時、イメージングに必須な蛍光色素導入の有用なタグである。作製した蛋白質により運動可能なモータードメインは単頭であるN末から351残基まででよく、352残基以降の長いネックの役割は首振りのレバーとして機能していると言うよりはcoild-coil構造をとって双頭構造を作り、安定に長距離運動するのに必要であり、キネシンの運動はバイアスのかかったブラウン運動で動いていること、そしてキネシンのネックはむしろ柔らかいジョイントの役目を果たしていることが解った(Inoue Y et.al, PNAS. 94: 7275-7280,1997, Inoue Y et.al, Biophys. J, submitted)。
続いて、キネシンの運動と分子内構造変化との関係を調べる目的でショウジョウバエのキネシンのモータードメイン中に存在する5つのシステイン残基を他のアミノ酸残基に置き換えた組み換え体(システイン欠失体)を作製した。それはキネシンのモータードメインの特異的部位に蛍光色素を導入するための基本になる蛋白質を作製するためである。運動能はATPase活性、力、滑走速度などにより評価され、その結果ATPおよび微小管に対する親和性は低下したが、発生する力はシステイン残基のあるキネシン組み換え体のそれと変化なかった。部位特異的に蛍光色素の導入を行うためにN末から45番目のシステインだけを戻したシステイン欠失体に蛋白質表面の疎水、親水環境に応じて蛍光波長が変化する色素、アクリロダンを導入し、微小管存在下でキネシンの微小管結合部位の反対側が疎水環境になっている事が解った(Iwatani S et.al, Biochemistry.38: 10318-10323,1999)。キネシンに結合しているヌクレオチドをマグネシウムでキレートしても同様な変化が見られた。今後、このシステイン欠失体を基礎に1分子蛍光計測へ応用する事で構造変化と機能との関係の解明につながると考えている。
さらにキネシンのATPase活性、運動能に対する局所麻酔薬の効果並びにキネシン尾部ドメイン自身によるモータードメインの機能調節をキネシンの組み換え体を用いて検討した。
局所麻酔薬は FAAT(fast anterograde axoplasmic transport:神経細胞の速い軸索輸送)を抑制することが知られているが、その作用機序は不明であった。近年、FAATはキネシンスーパーファミリータンパク質がオルガネラ・小胞等に結合し、これらを微小管に沿って輸送することによって行われていることが明らかとなった。そこでウシ及びヒトキネシンの運動アッセイ(多分子系・1分子系)に対する局所麻酔薬の直接的な効果を調べた。ヒトキネシンは十分な運動活性が期待されるN末から560番目までの長さのペプチドを大腸菌を用いて発現・精製した。そのC末側には1分子アッセイのイメージングに必要な蛍光色素を特異的に導入するための反応性の高いチオール基をつなげてある。局所麻酔薬はキネシンの化学エネルギー変換の指標となるATPase活性に影響を与えることなく、キネシンによる微小管の運動(多分子系)を可逆的に完全に止め、また、用量依存的にキネシンの運動能を1分子レベルでも阻害した。キネシン運動能を阻害した局所麻酔薬濃度は、これまでにFAATを抑制すると報告されている局所麻酔薬濃度とよく一致した。したがって、キネシン運動能の直接阻害作用が、局所麻酔薬による軸索輸送阻害作用の主因であることが明らかとなった((Miyamoto Y et. al, Biophysical J. , 78: 940 - 949, 2000)。http://www.med.osaka-u.ac.jp/pub/anes/www/home.html
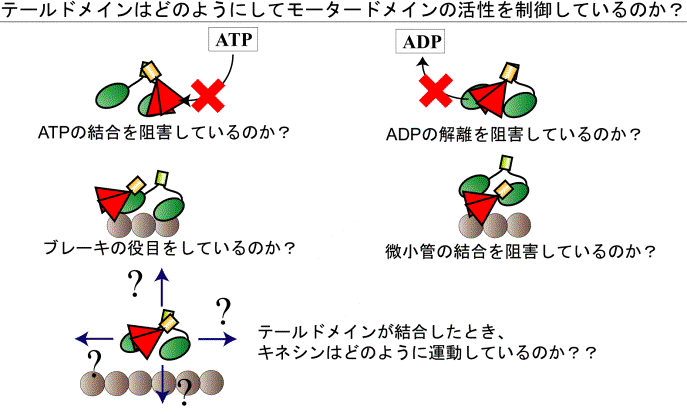
B キネシンは、N末側にキネシンの運動性に重要なモータードメイン、C末側に輸送対象の識別、結合に重要なテールドメインを持ち、その間は長いコイルドコイルにより構成されている。N末にあるモータードメインがATP加水分解で生じるエネルギーを利用し微小管上を一方向に連続的に運動することにより、キネシンは輸送対象を目的の場所へ輸送している。最近、テールドメインが荷物の識別・結合だけではなく、モータードメインの運動の制御を行っていることが少しずつ解ってた。小胞体や細胞内小器官などの輸送対象を持たないキネシンは、ヒンジを呼ばれるやわらかい部位で折れ曲がり、モータードメインとテールドメインが結合し、ATPase活性が抑制されると考えられている。しかし、テールドメインによるモータードメインのATPase活性制御の分子メカニズムは不明のままである。本研究では、遺伝子工学的手法、1分子イメージング法を用いて、テールドメインによる運動制御過程を1分子レベルで可視化し、テールドメインによるキネシンの運動制御のメカニズムの解明に迫った。
大腸菌で作製したショウジョウバエのキネシンのテールドメインとモータードメインの組み換え体でキネシンの運動制御を再構成する系を作製した。ATPase活性並びに運動能への影響(1分子レベルでのイメージング)を検討している。

1、微小管が促進するキネシンのATPase活性はテールドメインの濃度依存的にATPase活性が抑制したが、テールドメインの濃度を変化させてもKm値には差異はない。
2、蛍光標識したテールドメインと微小管との結合の観察。その結合は塩強度に強く依存。
3、蛍光標識したモータードメインの微小管上での運動の観察。並びにテールドメインによるモータードメインの運動能の抑制を1分子レベルで観察・解析。モータードメインと微小管との結合頻度はテールドメインの濃度依存的に低下。この結合頻度の低下の程度は、ATPase活性の低下のそれとほぼ一致。1分子レベルで運動しているモータードメインのその速度に関してはテールドメインの有無に依る差は認められない。
以上の結果から、テールドメインは、モータードメインと微小管の結合を阻害することでキネシンの運動制御を行っていることが示唆された。
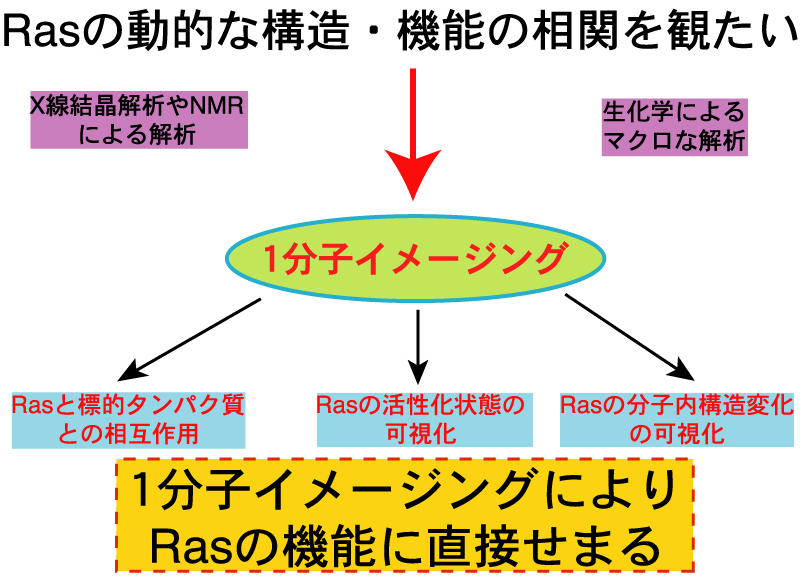
近年、正常細胞における外界適応や、癌細胞の運動性等を亢進する因子の1つとして、様々な低分子量G蛋白質が深く関与していることが明らかにされてきた。しかし、実際に低分子量G蛋白質が、細胞中の何処でどの様な時間経過でどれ位の分子数が活性化されると細胞の形態変化や細胞接着・運動性等との関係するのかは未だ不明な点が多い。一方、G蛋白質がシグナルを伝達させる標的蛋白質はいろいろ報告されているが、標的蛋白質の選び方はどの様に行われているのかも良く解っていない。低分子量G蛋白質の1つであるRasは活性型であるRas-GTPの時、Rasの分子内構造の動的な変化が生じていることがNMRを用いた研究で行われているが、この動的な分子内の構造のゆらぎと標的蛋白質の選択との間には何らかの相関関係があることが示唆される。これらを明らかにするために、生きた細胞中で低分子量G蛋白質の活性化状態や動的振る舞い並びにNMRでは計測することが難しい分子内のゆっくりとした動きを蛍光エネルギー移動法(FRET)を用いて可視化し、解析することを目的としている。
1、 蛍光色素や蛍光蛋白質が目的のイメージングに適しているように顕微鏡を開発
2、 Ras組換え体への蛍光色素の特異的な部位への導入
3、 活性化状態をイメージングするのに必要なGTP(or GDP)の蛍光色素の標識化
4、 G蛋白質の活性化状態の1分子レベルでの可視化
5、 GTP結合Rasの動的構造多形成を示唆するFRETの観察
6、 活性化状態のTMR-RasとRaf との動的な相互作用の1分子レベルでの観察
1.Y.Inoue, A. H. Iwane, T. Miyai, E. Muto & T. Yanagida Motility of single one-headed kinesin molecules along microtubles. Biophys. J. submitted
2.T. Yanagida & A. H. Iwane (2000) A large step for myosin. Proc. Natl. Acad. Sci. USA, 97 : 9357-9359
3. T. Yanagida, H. Tanaka, K. Kitamura, T. Wazawa, M. Nishiyama, S. Esaki, Y. Sako, T. Ide, A. H. Iwane & Y. Ishii (2000) Single molecule techniques inbiophysics. The proceedings of the 9th international conference on Na/K Pump and related pumps. ISC, 1207 : 71-85
4. Y. Miyamoto, E. Muto, T. Mashimo, A. H. Iwane, I. Yoshiya & T. Yanagida (2000) Direct Inhibition of Microtubule-based Kinesin Motility by Local Anesthetics. Biophys. J., 78 : 940-949
5. T. Yanagida, K. Kitamura, H. Tanaka, A. H. Iwane & S. Esaki (2000) Single molecule analysis of the actomyosin motor. Current Opinion in Cell Biology,12 : 20-25
6. T. Yanagida, S. Esaki, A. H. Iwane, Y. Inoue, A. Ishijima, K. Kitamura, H. Tanaka & M. Tokunaga (2000) Single motor mechanics and models of the myosin motor. The Royal Society Philosophical Transactions B. 355 :1-7
7. K. Kitamura, A. H. Iwane & M. Tokunaga (2000) A single myosin head moves along an actin filaments with regular steps during one biochemical cycle of ATP hydrolysis. Biophysics, 228 : 89-93
8. S. Iwatani, A. H. Iwane, H. Higuchi, Y. Ishii & T. Yanagida (1999) Mechanical and Chemical Properties of Cysteine-Modified Kinesin Molecules. Biochemistry, 38 : 10318-10323
9. 岩根敦子(1999)骨格筋ミオシンS1-GFP融合タンパクの試験管内発現と1分子アッセイ Cytometry Research, 9 :11-20
10. K. Kitamura, M. Tokunaga, A. H. Iwane & T. Yanagida (1999) A single myosin head moves along an actin filament with regular steps of 5.3 nanometres. Nature 397 : 129-134
11. X. Liu, K. Ito, S. Morimoto, A. H. Iwane, T. Yanagida & T.Q. P. Uyeda (1998) Filament structure as an essential factor for regulation of Dictyostelium myosin by regulatory light chain phosphorylation. Proc. Natl. Acad. Sci. USA 95 : 14124-14129
12. Y. Miyamoto, T. Mashimo, A. H. Iwane, I. Yoshiya & T. Yanagida (1998) Direct inhibition effects of local anesthetics on microtuble associated motor protein kinesin : Molecular mechanisms of the inhibition of axoplasmic transport by local anesthetics麻酔と蘇生, 34 : 229-230
13. Y. Miyamoto, T. Mashimo, Y. Tsuda, A. H. Iwane, I. Yoshiya & T. Yanagida (1997) Direct inhibition effects of local anesthetics on microtuble associated motor protein kinesin investigated by in vitro motility assay and single-molecule imagaing.麻酔と蘇生, 33 : 249-250
14. A. H. Iwane, K. Kitamura, M. Tokunaga & T. Yanagida (1997) Myosin subfragment-1 is fully equipped with factors essential for motor function. Biochem. Biophys. Res. Commun., 230 : 76-80
15. A. H. Iwane, T. Funatsu, Y. Harada, M. Tokunaga, O. Ohara, S. Morimoto & T. Yanagida (1997) Single molecular assay of the individual ATP turnovers by a myosin-GFP fusion protein expressed in vitro. FEBS Lett., 407 : 235-238
16. M.Tokunaga, K. Kitamura, K. Saito, A. H. Iwane & T. Yanagida (1997) Single molecular imaging of fluorophores and individual enzymatic reactions simply achieved by objective-type total internal reflection fluorescence microscopy. Biochem. Biophys. Res. Commun., 235 : 47-53
17. K. Saito, M. Tokunaga, A. H. Iwane & T. Yanagida (1997) Dual-colour microscopy of single fluorophores bound to myosin interacting with fluorescently labelled actin using anti-Stokes fluorescence . Journal of Microscope,188 : 255-263.
18. Y. Inoue, Y.Y. Toyoshima, A. H. Iwane, S. Morimoto & T. Yanagida (1997)Movements of truncated kinesin fragments with a short or an artificial flexible neck. Proc. Natl. Acad. Sci. USA , 94 : 7275-7280